김경철 웰케어컨설팅 부사장

세계적으로 헬스케어는 산업계에서 가장 중요한 위치를 차지하고 있고 매년 폭발적인 성장세를 보이고 있다. 단순한 서비스의 제공과 일대일의 관계에서 효율성, 경제성, 편의성, 신속성, 미래발전성을 기반으로 한 다자간 연결 시스템으로 발전하고 있는 가운데 그 중심에는 소위 'Digital Health care transformation’이 핵심으로 자리매김하고 있다. 이에 병원신문과 대한디지털헬스학회는 4차 산업혁명을 맞아 역동적인 디지털헬스케어 생태계 조성을 위해 '이제는 디지털헬스 시대다!'를 공동기획했다.
※ 대한디지털헬스학회: 4차 산업혁명과 디지털전환이라는 시대적 요구에 부응하고자 2021년 11월 학계, 의료계, 산업계 전문가들이 상호 협력하고 교류할 수 있는 비영리 학술단체로 창립했으며 권순용 가톨릭대학교 서울성모병원 정형외과 교수가 초대회장을 맡았다.
※ 병원신문-대한디지털헬스학회 공동기획③: 유전체와 인공지능, 디지털 헬스케어의 만남(김경철 웰케어컨설팅 부사장)

현재 전 세계적으로 가장 뜨거운 키워드들이 정밀의학, 빅데이터, 인공지능 (Artificial Intelligence, AI) 혹은 딥러닝, 그리고 블록체인 등이다. 이들 BT와 IT들의 전혀 다른 아젠다들이 서로 만나 새로운 시너지를 낼 수 있는 이유는 이들 모두가 빅데이터를 기반으로 하기 때문이다. 즉 사람의 능력으로 다룰 수 없는 수많은 정보들이 딥러닝 방식으로 자동적으로 계산이 되고 상황에 맞게 적용될 수 있어야 비로소 정밀의학이 가능하고, 이런 빅데이터들은 오프라인이 아닌 온라인 기반의 클라우드에 있어야 수시로 사용할 수 있는데 이때 발생할 수 있는 데이터의 안전한 보호를 위해서도 블록체인과 연계되어야 하는 것이다. 이번 편에선 유전체 데이터들이 어떻게 IT와 만나 새로운 의미를 더하는지 살펴보고자 한다.
■ 구글의 인공지능 암진단 기술
2108년 미국암학회(AACR) 기조 강연으로 구글 인공지능팀의 마틴 스텀프(Martin C. Stumpe)와 제이슨 히프(Jason D. Hipp) 두 명의 구글 인공지능 연구자들이 나와 구글의 인공지능 기술로 암을 진단하는 내용을 소개했다. IT 기업인 구글이 첫 기조강연을 시작한 것은 미국암학회 110년 역사상 처음 있는 일이었으며, 이 자체로도 의미가 크다고 볼 수 있다. 사실 구글이 미국암학회에서 처음으로 발표하는 자리는 아니었다.
워싱턴 DC에서 있었던 2017년 미국암학회에서도 구글의 마크 데프리스토(Mark DePristo)가 ‘인공지능(AI)을 이용한 암 치료’ 세션에서 발표했다. 2017년 미국암학회 발표는 브로드 연구소(Broad institute)에서 GATK(유전자정보분석)를 개발하고 몇 년 전에 인공지능 기술을 이용해 구글의 게놈 빅데이터를 분석하는 장으로 옮긴 마크 데프리스토 박사가 직접 발표해 더욱 의미가 있었다. 이날 세미나장은 구글의 첫 인공지능 기술 세미나를 듣기 위해 일찌감치 마감됐다.
옆 세미나실에서 영상으로 대신 진행이 될 정도로 구글의 발표는 암 연구자와 임상 의사들의 관심을 받았다. 구글은 벌써 당뇨망막병증(diabetic retinopathy)을 진단하는 툴을 개발했고, 그런 구글의 데프리스토팀이 암의 이질성(heterogeneity)을 처리하는 쪽으로 접근하고 있다고 한다. 전 세계에서 가장 빠르게 이 문제를 해결하지 않을까 했는데, 올해는 실제 구글이 암 환자의 병리학 이미지 데이터를 이용해 암을 진단하는 서비스를 개발하는 전 과정을 소개한 것이다.
이번에 발표된 전이성 유방암 진단은 이미지 크기는 매우 큰 데 반해 아주 작은 크기로 존재하는 전이암 세포를 눈으로 찾아내기는 매우 어려웠다. 마틴 스텀프가 말하길 어떤 림프절 일부는 양성종양(benign tumor)임에도 불구하고 전이암처럼 보일 때도 있다고 했다. 그리고 병리과 의사가 진단해야 하는 한 환자의 한 조직 생검(biopsy)에서 나오는 이미지는 약 1000개의 DSLR 이미지로 구성돼 있다.
이 방대한 이미지 데이터를 들여다보고 최종적으로 판단을 해야 하는 어려움이 있다고 한다. 이러한 문제를 해결하기 위해 구글 인공지능팀은 조직 생검 이미지 데이터를 수백만 개 타일로 분할해 각 타일을 양성종양 또는 전이종양으로 라벨링했다. 이를 수백만 번 반복적으로 학습한 다음 전이종양으로 분류하는 것이 가능해졌다.
이로 인해 유방암 전이를 진단하는 데 AI가 병리의사보다 더 빠르고 정확해졌다고 했다. 연구팀이 종양 위치파악점수(Tumor localization score, FROC)를 확인한 결과 병리 의사는 평균 0.73인데 반해 구글 AI는 0.91이 나왔다. 전립선암을 글리슨 등급(Gleason grade)을 부여해 악성 종양을 진단하는 데는 병리 의사와 비슷한 성적을 낸 것으로 나타났다. 이런 구글의 노력을 통해 조만간 암을 현미경으로 진단하는 것이 아니라, 데이터를 통해 진단하는 시대가 올 것이다.
■ 유전체와 인공지능의 만남
우리를 충격에 빠뜨렸던 이세돌과 알파고의 대결도 벌써 6년이 지났다. 그 후 사회 각 분야에서 인공지능은 시대의 화두가 됐고 적용이 안되는 분야가 없게 됐다. 그 중에 빅데이터를 다루는 유전체 분야에의 인공지능 기술 적용은 필연적이다. 사람의 능력으로 유전체를 분석하는 것은 거의 불가능해 인공지능이 스스로 학습하고 발전하면서 인간의 속도를 뛰어넘기 때문이다. 최근 유전체 의학 분야에서도 적용 가능한 강력한 딥러닝 및 인공지능 알고리즘들이 개발되고 있다. 이들 알고리즘은 기존에는 1,000개 이상의 노드(1만6,000개 이상의 CPU)를 가진 분산형 병렬 처리 컴퓨터에서만 가동 가능했으나, 지금은 대규모 기계 학습(machine learning)에 적합한 GPU 클러스터가 나와 빠르고 경제적으로 대규모 기계 학습 가능해졌다.
이로 인해 인공지능 기술을 이용한 유전체 빅데이터 분석 관련 연구 및 비즈니스는 급속히 발전하고 있으며, 유전체 빅데이터와 딥러닝 기술이 탑재된 인공지능 프로그램이 머지않아 우리 앞에 성큼 다가올 것으로 전망된다.
그 중 대표적인 회사로 토론토 대학의 브렌던 프레이(Brenden Frey)가 스핀오프(spin-off)한 스타트업 회사인 딥지노믹스(Deep Genomics)가 있다. 딥지노믹스는 기계 학습과 유전체 빅데이터를 결합해 맞춤형 의료 서비스를 제공하는 것을 목표로 하고 있다.
즉 기계 학습을 통해 통합된 인공지능 기술을 이용해 질병을 진단하고 개인 맞춤 치료를 위해 사람의 능력보다 더 뛰어나고 빠르게 환자를 위한 정보를 임상 의사들에게 제공하고자 하는 것이다. 유전체와 의료 데이터 분석을 통해 작고 미묘한 신호를 찾아 정밀의학, 유전체 검사 그리고 신약을 개발하는 것을 목표로 삼고 있다. 이 회사는 단일 유전자 변이로 인해 유전되는 유전 질환을 집중적으로 다루고 이들 대상으로 신약을 개발하고 있다.
국내에서도 유전체 빅데이터 기반 AI 신약개발회사인 신테카바이오의 경우 인실리코 임상 관련 유전자, SNP, 단백질, 의약화학물 간의 관계에 대한 연관 정보를 종합적으로 추출할 수 있는 BioMap 시스템을 보유하고 있다. 인실리코는 컴퓨터 시뮬레이션을 이용해 가상 환경에서 실험하는 방법을 말한다. 시뮬레이션 기술이 가속화되고 예측 정확성이 향상되면서 인실리코 모델링 기술과 정상·변이 단백질에 대한 약물의 상호작용, 약물의 약효를 예측하는 시뮬레이션 기술이 주목받고 있다. 그 외 유전적 다양성으로부터 유래된 단백질의 변이가 약물과의 상호작용에 미치는 영향을 예측하는 분자동역학 기반 시뮬레이션 시스템, 약물 가상 탐색 시스템 기술을 보유하고 있다.
2016년 1월 당시 미국 부통령이었던 조 바이든(Beau Biden) 미국 대통령은 Cancer Moonshot을 제안했고 이를 통해 연구자, 정부, 기업들이 협력해 암 환자 데이터 공유를 위한 거대한 프로젝트가 시작됐다. 그리고 이 정책적 근거로 미국국립암연구소(NCI)에 의해 펀딩된 모든 유전체 데이터들을 통합해 GDC(Genome Data Commons)를 구축해 나가고 있다.
미래 의학은 빅데이터 없이는 구현하기 어렵다는 판단 아래 미국 정부는 Cancer Moonshot과 PMI Oncology 프로젝트를 시작해 적어도 분자 레벨의 암 서브타입(cancer subtype)을 결정해보자는 첫 목표를 향해 방대한 암 환자 데이터를 수집하는 것이다. 그리고 이를 확장해 암 연구자들의 다양하고 복잡한 암 연구 니즈를 만족시키기 위해 가장 기초가 되는 데이터들을 제공하는 것을 목적으로 설계하고 데이터들을 생산·관리·배포하고 있다.
이런 기회를 맞아 전 세계 암 연구자와 인공지능 및 딥러닝 전문가들은 서로 협력해 이 데이터를 이용한 새로운 진단법 및 치료법을 개발하기 위해 노력 중에 있으며 머지않아 딥러닝&암 오믹스 빅데이터에 기반한 수많은 연구성과들이 나올 것으로 예상된다.
■ 유전체와 블록체인의 만남
최근의 또 하나의 화두는 블록체인(block chain)이다. 블록체인은 블록(block)과 체인(chain)의 합성어로, 누구나 열람할 수 있는 장부에 거래 내역을 투명하게 기록하고 여러 대의 컴퓨터에 저장하는 분산형 데이터 저장기술이다. 블록기술이 사용된 가장 성공한 사례로는 가상화폐인 비트코인(Bitcoin)이 꼽히고 있다.
블록체인에서는 거래가 발생한 시간 순서에 따라 모든 거래 데이터가 기록되고 모든 네트워크 참여자(노드, Node)가 동일한 정보를 공유하기 때문에 기본적으로 모든 정보가 투명하게 개방된다. 또한 노드 하나가 해킹으로 변조되더라도 블록체인 네트워크상 나머지 노드가 가지고 있는 데이터는 그대로다.
이 때문에 데이터를 임의로 변경하기 위해서는 네트워크에 참여하는 모든 컴퓨터를 동시에 해킹해야 한다는 어려움이 있다. 개인의 프라이버시가 강한 데이터를 안전하게 보관하고 여럿이 함께 공유도 할 수 있는 기술로 이 블록체인과 유전자 데이터가 만나기 시작했다.
유전체의학의 세계적 석학인 미국 하버드의대 조지 처치(George Church) 교수가 공동 설립한 스타트업인 네뷸라 지노믹스(Nebula Genomics)는 최근 ‘블록체인 가능한 유전자 데이터 공유 및 분석 플랫폼’ 백서를 발간, 전장유전체 분석(WGS)은 1,000달러 이하, 엑솜 시퀀싱(Exome Sequencing)은 300달러 이하의 저렴한 가격에 제공하면서, 유전자 데이터 소유권을 소비자 개인이 갖도록 하는 비즈니스 모델을 2018년 2월에 공개했다.
일루미나(Illumina)의 헬릭스(Helix)나 23andme와 같은 기존 소비자 직접 의뢰(DTC) 개인 유전체 분석 전문기업들은 개인이 돈을 지불하면 분석 결과를 알려주고, 유전체 정보는 보관하다 제약 및 생명공학회사에 연구 및 개발용으로 판매해왔다. 그러나 네뷸라 모델은 데이터 소유자와 구매자 간 중개자로 개인 유전체 회사를 제외한다. 대신 소유자가 네뷸라의 블록체인 기반 피어 투 피어(peer-to-peer) 네트워크에 가입해 데이터 구매자와 직접 접촉할 수 있다.
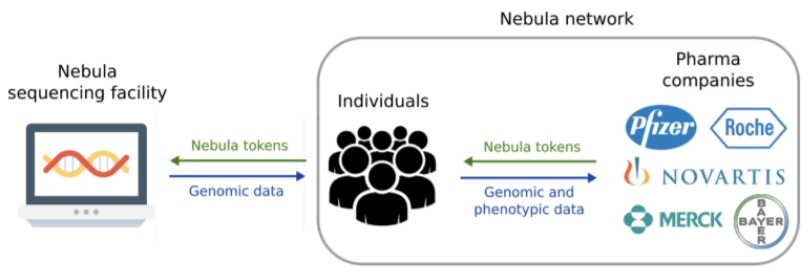
네뷸라는 시퀀싱 비용을 줄이는 방법으로 두 가지를 제시했다. 먼저 아직 유전체 분석을 하지 않은 개인이 네뷸라 네트워크에 가입한 뒤 유료 설문조사에 참여하는 것이다. 데이터 구매자는 특정 질병과 같은 관심 있는 표현형을 가진 개인을 식별해, 유전체 분석 비용에 보조금을 제공할 수 있다.
네뷸라는 시퀀싱 기술이 발전하고 시퀀싱 비용이 감소하면서 향후 데이터 구매자가 개인 유전체 분석 비용을 완전히 지불할 수 있게 될 것으로 기대했다.두 번째는 개인이 네뷸라 시퀀싱 시설이나 다른 개인 유전체 회사로부터 받은 자신의 데이터 접근권을 네뷸라 네트워크를 통해 유료로 판매해 이익을 얻는 것이다. 네뷸라는 시퀀싱 비용을 낮추면 더 많은 사람들이 유전자 검사에 참여하고, 결과적으로 의료 연구에 도움이 될 유전체 데이터도 증가할 것이라고 내다봤다. 네뷸라 네트워크에서 개인 데이터는 다양한 메커니즘을 통해 보호된다.
백서에 따르면 우선 데이터 소유자는 개인적으로 유전자 및 표현형 데이터를 저장하면서 누구에게 접근권을 줄지 제어할 수 있다. 공유된 데이터는 인텔 SGX(Software Guard Extensions)와 동형암호(homomorphic encryption)를 사용해 암호화되고 안전하게 분석되기 때문에 데이터 구매자는 절대 암호문의 원문(plaintext)을 볼 수 없다.
또한 데이터를 공유하고 대가를 지불하는 동안 데이터 소유자는 익명으로 처리되고, 네뷸라 네트워크 주소는 개인 정보와 관계 없는 암호화 식별자로 처리된다. 데이터 구매자는 네뷸라가 신원을 확인한 완전히 투명한 사람에 한하며, 모든 거래 기록은 네뷸라 블록체인에 영구 저장된다. 네뷸라 네트워크에서 거래되는 화폐는 '네뷸라 토큰(Nebula tokens)'이다.
개인이 네뷸라 토큰으로 개인 유전체 분석 결과를 구매하면, 데이터 구매자가 네뷸라 토큰으로 유전체 및 표현형 데이터 접근권을 얻을 수 있다. 네뷸라는 데이터 구매자에게 실물화폐를 받고 네뷸라 토큰을 판매한다. 네뷸라 네트워크는 블록스택(Blockstack) 플랫폼과 이더리움 파생 네뷸라 블록체인을 기반으로 만들어진다.
네뷸라는 "향후 분산된 데이터 저장과 안전한 계산이 가능하도록 해 네뷸라가 유전체 데이터 보호를 위한 새로운 표준을 수립할 것"이라면서 "장기적인 목표는 표현형 데이터를 지원하는 것으로, 표현형 정보와 유전체 정보를 통합해 가치있는 인사이트를 제공하는 개인건강기록(PHR) 시스템으로 거듭날 계획"이라고 밝혔다.
주정부가 직접 블록체인 기반 DNA 데이터 구축에 나선 사례도 있다. 독일 기반 유전체 스타트업 시봄(Shivom)은 3월 말 인도 안드라프라데시(Andhra Pradesh) 주와 파트너십을 체결했다. 안드라프라데시주에는 현재 6,000만 명이 거주하고 있으며, 주정부는 2025년까지 모든 거주민들의 유전자를 분석할 계획이다.
시봄은 시민들의 DNA 프라이버시를 유지하기 위해 블록체인 기술을 사용해, 암호화된 데이터를 저장한 뒤 지정된 사용자만 사용할 수 있도록 하는 한편 동시에 분산 저장을 통해 트랜잭션 비용을 절감할 예정이다. 시봄 측은 이뿐만 아니라 타비 로이바스(Taavi Rõivas)에스토니아 전 총리와 안타나스 구오가(Antagonas Guoga) 유럽의회 의원 등 영향력 있는 사람들이 시봄의 성장과 개발 노력을 지원하기 위해 시봄혁신위원회(Shivom Innovation Council)에 가입했다고 밝혔다.
■ 미래 의학 어떻게 발전할 것인가?
개인의 인체유래물에서 선천적, 혹은 후천적으로 변한 데이터들이 빅데이터를 이뤄 개인의 특성을 결정하고, 질병을 일으키는 과정들을 보게 되었을 것이다. 이 빅데이터를 빠르게 분석하고 적절할 때 사용할 수 있어야 빅데이터가 정밀의학으로 연결될 것이다.
미래의학의 핵심은 이 빅데이터를 얼마나 쉽게 이용하는데 있을 것이다. 즉 앞으로는 모바일, 혹은 사물인터넷 등을 통해 개인의 데이터들이 즉시성을 가지고 구현되어 진단이나 치료 등 질병 분야뿐 아니라, 모든 삶의 중심에서 이 데이터들이 활용되어 질 것이다.
IT와 BT의 만남은 이제 미래 의학을 설명하는 가장 핵심 융합 지점이다. 바이오 지식도 낯설고 컴퓨터 기술은 더욱 낯선 대부분의 임상의사들에겐 이 모든 변화가 벅차겠지만, 누군가는 더 쉽고 간단하게 이 지식들을 진료 현장에, 일상의 삶 속에 가지고 오게 할 것이니 너무 걱정할 필요는 없다.


