‘의료기기 규제혁신 방안’ 후속조치.. 시장 진입기간 최대 390일로 단축
정부는 신의료기술평가와 보험등재심사를 동시에 진행하도록 하기 위한 ‘신의료기술평가에 관한 규칙’ 개정안을 5월9일부터 6월16일까지 40일간 입법예고 한다.
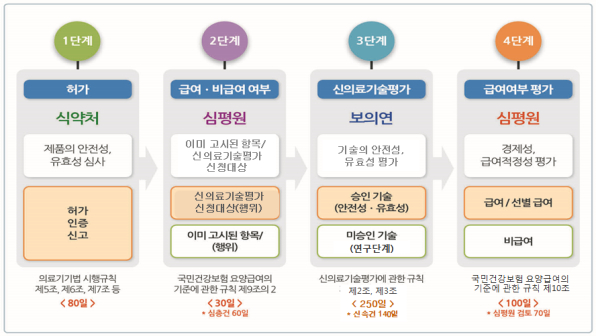
새로운 의료기술이 포함된 신개발 의료기기의 보험등재를 위해서는 식품의약품안전처 허가 이후에도 요양급여·비급여 대상확인 및 신의료기술평가 등을 거쳐야 하므로 그간 시장 진입이 최대 490일에 달했다.이에 따라 정부는 지난해 7월19일 신개발 의료기기가 시장에 빠르게 진입할 수 있도록 신의료기술평가와 보험등재심사를 동시에 진행하는 절차를 마련하는 내용 등을 담은 ‘의료기기 규제혁신 및 산업육성방안’을 발표한 바 있다.
이를 위해 한국보건의료연구원(원장 이영성)과 건강보험심사평가원(원장 김승택)은 제도개선 협의체를 구성해 구체적인 방안을 모색해 왔다.이번 ‘신의료기술평가 규칙’(보건복지부령) 개정안은 그간 협의된 내용을 바탕으로 신의료기술평가와 보험등재심사를 동시 진행해 신개발 의료기기의 시장 진입 기간을 단축하도록 하고 있다.
신의료기술평가 시 한국보건의료연구원에 보험급여 등재를 위한 자료를 제출할 경우 건강보험심사평가원의 보험등재심사도 자동으로 진행된다.이에 따라 신의료기술평가가 완료될 때 보험급여 등재심사도 종료, 의료기기의 시장 진입 기간이 100일가량 단축된다.
보건복지부는 입법예고 기간 중 국민의 의견을 폭넓게 수렴한 후 개정안을 확정할 예정이다. 이번 개정안에 대해 의견이 있는 단체 또는 개인은 2019년 6월16일까지 보건복지부 의료자원정책과로 의견을 제출하면 된다.
저작권자 © 병원신문 무단전재 및 재배포 금지


